Cinética y Equilibrio Químico
Introducción
El concepto de equilibrio es fundamental para conocer y entender la química y el comportamiento de las sustancias. En la constante de equilibrio se refleja la tendencia que tienen las sustancias de reaccionar, así como también, la dirección y magnitud del cambio químico. Todas las reacciones químicas pueden ser descriptas bajo una condición de equilibrio.
Todos los sistemas químicos alcanzan en el tiempo la condición de equilibrio El estado de equilibrio químico es de naturaleza dinámica y no estática.
El Equilibrio En Sistemas Químicos
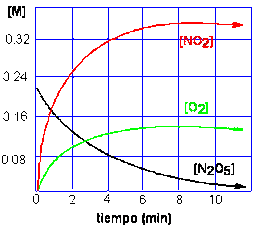
Cuando se coloca en un recipiente de volumen conocido a temperatura constante una muestra de 2N2O5(g), éste se descompone: 2N2O5(g) ------> 4NO2(g) + O2(g)
Cuando la concentración de los productos aumenta los mismos se convierten en reactantes:
4NO2(g) + O2(g) ----------> 2N2O5(g)
Reacciones Irreversibles
Finalmente, las dos reacciones evolucionan de modo tal que sus velocidades se igualan, estableciéndose un equilibrio químico. Bajo estas condiciones la reacción es reversible y se representa de la siguiente manera:
En una reacción reversible, la reacción ocurre simultáneamente en ambas direcciones.
2N2O5(g) <--------> 4NO2(g) + O2(g)
Lo anterior se indica por medio de una doble flecha En principio, casi todas las reacciones son reversibles en cierta medida constante de equilibrio Keq
Una vez alcanzado el equilibrio las concentraciones de reactantes y productos no cambian en el tiempo.
El equilibrio dinámico establece que a medida que el reactante se descompone, los productos se combinan entre sí para mantener las concentraciones constantes, las cuales se relacionan en la siguiente ecuación (productos en el numerador, reactivos en el denominador):
Introducción
El concepto de equilibrio es fundamental para conocer y entender la química y el comportamiento de las sustancias. En la constante de equilibrio se refleja la tendencia que tienen las sustancias de reaccionar, así como también, la dirección y magnitud del cambio químico. Todas las reacciones químicas pueden ser descriptas bajo una condición de equilibrio.
Todos los sistemas químicos alcanzan en el tiempo la condición de equilibrio El estado de equilibrio químico es de naturaleza dinámica y no estática.
El Equilibrio En Sistemas Químicos
Cuando se coloca en un recipiente de volumen conocido a temperatura constante una muestra de 2N2O5(g), éste se descompone: 2N2O5(g) ------> 4NO2(g) + O2(g)
Cuando la concentración de los productos aumenta los mismos se convierten en reactantes:
4NO2(g) + O2(g) ----------> 2N2O5(g)
Reacciones Irreversibles
Finalmente, las dos reacciones evolucionan de modo tal que sus velocidades se igualan, estableciéndose un equilibrio químico. Bajo estas condiciones la reacción es reversible y se representa de la siguiente manera:
En una reacción reversible, la reacción ocurre simultáneamente en ambas direcciones.
2N2O5(g) <--------> 4NO2(g) + O2(g)
Lo anterior se indica por medio de una doble flecha En principio, casi todas las reacciones son reversibles en cierta medida constante de equilibrio Keq
Una vez alcanzado el equilibrio las concentraciones de reactantes y productos no cambian en el tiempo.
El equilibrio dinámico establece que a medida que el reactante se descompone, los productos se combinan entre sí para mantener las concentraciones constantes, las cuales se relacionan en la siguiente ecuación (productos en el numerador, reactivos en el denominador):
formula
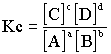
donde [ ] indica las concentraciones de moles/litros y Kc es la constante de equilibrio.
Las constantes de equilibrio proporcionan información muy útil sobre si la reacción se desplaza hacia la formación de productos o hacia la formación de reactivos. Keq > 1, se desplaza hacia la formación productos
Keq < 1, se desplaza hacia la formación de reactivos
Velocidad de Reacción
La velocidad de reacción es una magnitud positiva que expresa cómo cambia la concentración de un reactivo o producto con el tiempo.
Velocidad de Reacción
La velocidad de reacción es una magnitud positiva que expresa cómo cambia la concentración de un reactivo o producto con el tiempo.
La velocidad de reacción es directamente proporcional a la concentración de los reactivos.
Las reacciones son el resultado de las colisiones entre moléculas de reactivos. Cuanto mayor es [moléculas], mayor es el número de colisiones por unidad de tiempo, por lo que la reacción es más rápida. Cuando el reactivo limitante se consume, la velocidad es cero.
Ejemplo de Equilibrio Quimico
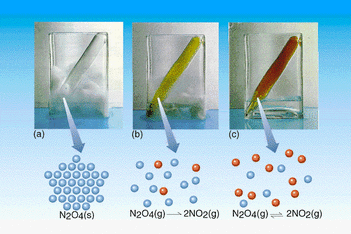
El punto en el cual la velocidad de descomposición:
N2O4(g) -------> 2NO2(g)
es igual a la velocidad de dimerización:
2NO2(g) -------> N2O4(g)
es un equilibrio dinámico. El equilibrio es dinámico porque la reacción no ha parado: Las velocidades de los dos procesos son iguales
Las reacciones son el resultado de las colisiones entre moléculas de reactivos. Cuanto mayor es [moléculas], mayor es el número de colisiones por unidad de tiempo, por lo que la reacción es más rápida. Cuando el reactivo limitante se consume, la velocidad es cero.
Ejemplo de Equilibrio Quimico
El punto en el cual la velocidad de descomposición:
N2O4(g) -------> 2NO2(g)
es igual a la velocidad de dimerización:
2NO2(g) -------> N2O4(g)
es un equilibrio dinámico. El equilibrio es dinámico porque la reacción no ha parado: Las velocidades de los dos procesos son iguales
- En el equilibrio, el N2O4 reacciona para formar una determinada cantidad NO2, y esta misma cantidad de NO2(g) reacciona para volver a formar N2O4
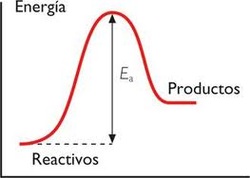
Teoría de las Colisiones
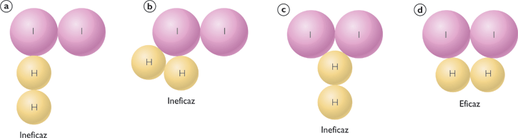
Las reacciones químicas se producen por los choques eficaces entre las moléculas de reactivos.
Las reacciones químicas se producen por los choques eficaces entre las moléculas de reactivos.
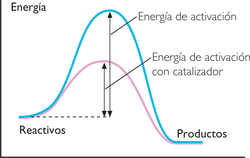
Además del choque adecuado las moléculas tienen que tener una energía suficiente, esta energía mínima se denomina energía de activación.
composición en equilibrio de una mezcla:
- Establece que si un sistema en equilibrio es sometido a una perturbacion o tensión, el sistema reaccionará de tal manera que disminuirá el efecto de la tensión.
composición en equilibrio de una mezcla:
- cambio de concentración de reactivos o productos.
- cambio de temperatura
- cambio de presión parcial de reactivos o productos cambiando en volumen
- La temperatura tiene un efecto significativo sobre la mayoría de reacciones químicas.
- Las velocidades de reacción normalmente se incrementan al aumentar la temperatura. Consecuentemente, se alcanza más rapidamente el equilibrio.
- Los valores de la constante de equilibrio (Keq) cambian con la temperatura.
- Consideremos al calor como un producto en la reacción exotérmica o como un reactivo en las reacciones endotérmicas.
- Según lo anterior, podemos observar que si se aumenta la temperatura en una reacción exotérmica es lo mismo que si agregaramos más producto, por lo que la reacción se desplaza hacia la izquierda.
Para Una Reacción Endotermica
- Si se aumenta la temperatura en una reacción endotérmica es similar a agregar más reactivos, por lo que la reacción se desplaza hacia la derecha.
- Incrementar la temperatura sería análogo a agregar más reactivos.
- De acuerdo al principio de Le Chatelier, cuando la temperatura aumenta, el equilibrio se desplaza hacia la formación de productos.
- Si se disminuye la temperatura, el equilibrio se desplaza hacia la formación de reactivos.
- Incrementar la temperatura sería análogo a agregar más producto.
reactivos <-----> productos + calor (variacion de H es negativo)
- De acuerdo al principio de Le Chatelier, si se aumenta la temperatura el equilibrio se desplazará hacia la formación de reactivos.
- Si se disminuye la temperatura, el equilibrio se desplaza hacia la formación de productos
Efecto Del Cambio de Presión
- Los cambios de presión pueden afectar los sistemas gaseosos homogéneos en equilibrio.
- Los cambios de presión no afectan sistemas homogéneos solidos o liquidos, pero afectan los sistemas heterogéneos en los que interviene un gas.
- Los cambios que se producen en la presión interna no afectan el equilibrio.
- Un aumento en la presión externa hace evolucionar al sistema en la dirección del menor número de moles de gas y viceversa
- Un aumento en la presión externa hace evolucionar al sistema en la dirección del menor número de moles de gas y viceversa.
- Un aumento en la presión del siguiente sistema
- obliga a que el sistema se desplace hacia la derecha, hay cuatro moles a la izquierda y solo dos a la derecha.